為(wèi)保證我院臨床試驗管理(lǐ)有(yǒu)序化(huà)、規範化(huà)和(hé)研究資料的(de")完整性,本機(jī)構結合實際情況,特制(zhì)定此流程,請(qǐng)申辦方/CRO參照(zhào)本要(yào)求規定的(de)具體(tǐ)流程進行(xíng)操作(zuò)。
一、提前終止的(de)項目關中心流程
1.項目未啓動
申辦方/CRO遞交試驗項目終止函(附遞交信)-PI-倫理(lǐ)/機(jī)構;
相(xiàng)關物(wù)資、試驗用(yòng)藥品退還(hái)至申辦方/CRO;
不(bù)進行(xíng)機(jī)構質控。
2.項目啓動未篩選
申辦方/CRO遞交項目終止函(附遞交信)-PI-倫理(lǐ)/機(jī)構;
經費(fèi)核對(duì),按照(zhào)《臨床試驗項目費(fèi)用(yòng)結算(suàn)流程》執行(xíng);
相(xiàng)關物(wù)資、試驗用(yòng)藥品退還(hái)至申辦方/CRO;
不(bù)進行(xíng)機(jī)構質控;
臨床試驗相(xiàng)關文(wén)件(jiàn)根據《藥物(wù)臨床試驗質量管理(lǐ)規範》(2020年(nián))要(yào)求進行(xíng)保存,
如(rú)有(yǒu)特殊原因,申辦方需出具說(shuō)明(míng)。
3.項目篩選未入組
按照(zhào)項目結題的(de)關中心流程進行(xíng)關中心;
不(bù)進行(xíng)機(jī)構質控。
二、項目結題的(de)關中心流程
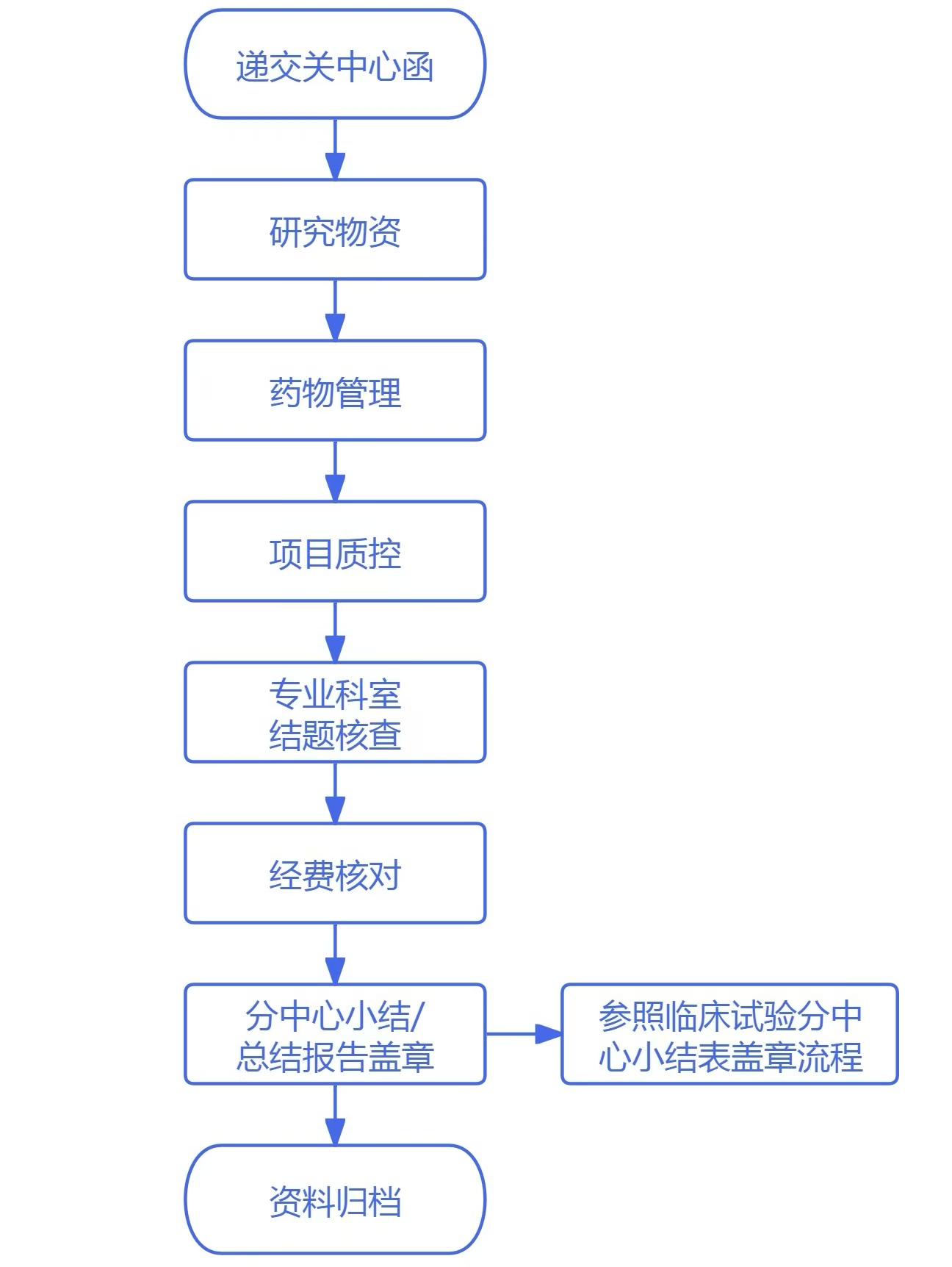
1.遞交關中心函
申辦方/CRO遞交關中心函(附遞交信),PI簽字後遞交。
2.研究物(wù)資
研究者/研究護士确認研究文(wén)件(jiàn)資料保存完整,研究物(wù)資已退回/處理(lǐ),記錄齊全,并在《臨床試驗結題簽認表》(附件(jiàn)1)中簽字;
3.藥物(wù)管理(lǐ)
GCP中心藥房(fáng)藥物(wù)管理(lǐ)員(yuán)負責确認剩餘試驗藥物(wù)已退回申辦方或銷毀,确認藥物(wù)記錄信γ息完整、資料齊全符合關中心要(yào)求,并在《臨床試驗結題簽認表》中簽字。
4.項目質控
專業(yè)科室質控:關中心前科室項目質控員(yuán)對(duì)項目進行(xíng)質控,并完成質控問(wèn)題的(de)整改,經研究者複核确認信息完整、資料齊全符合關中心要(yào)求,并在《臨床試驗結題簽認表》中簽字。
機(jī)構質控:機(jī)構完成該臨床試驗項目質控(首例、中期和(hé)結題),确認申辦方/CRO/SMO對(duì)項目的(de)監查、稽查結果反饋至機(jī)構;機(jī)構确認項目質控已完成,且質控問(wèn)題已反饋整改,符合關中心要(yào)求後在《臨床試驗結題簽認表》中簽字。
5.專業(yè)科室結題核查
項目負責Sub-I完成專業(yè)科室《臨床試驗結題核查表》(附件(jiàn)2),經PI複核确認信息完整、資料齊全符合關中心要(yào)求,主要(yào)研究者與核查人(rén)共同簽字确認。
6.經費(fèi)核對(duì)
申辦方按照(zhào)《臨床試驗項目結題》材料要(yào)求整理(lǐ),機(jī)構秘書(shū)核對(duì)并确認全部費(fèi)用(yòng)已結清,符合關中心要(yào)求後在《臨床試驗結題簽認表》中簽字。
7.分(fēn)中心小(xiǎo)結/總結報(bào)告蓋章(zhāng)(參照(zhào)臨床試驗分(fēn)中心小(xiǎo)結表蓋章(zhāng)流程)
申辦方向機(jī)構辦公室遞交《臨床試驗分(fēn)中心小(xiǎo)結表》進行(xíng)審核,機(jī)構辦公室審核完成後進行(xíng)簽章(zhāng)流程。可(kě)使用(yòng)項目組模版或參考本中心《多(duō)中心臨床試驗分(fēn)中心小(xiǎo)結表》模版。(詳見(jiàn)《分(fēn)中心小(xiǎo)結簽章(zhāng)流程》要(yào)求)
8.資料歸檔
機(jī)構檔案管理(lǐ)員(yuán)對(duì)試驗項目的(de)歸檔資料進行(xíng)審核,确認符合關中心要(yào)求後将所有(yǒu)試驗相(xiàng)關資γ料進行(xíng)整理(lǐ)歸檔(詳見(jiàn)《臨床試驗資料歸檔》要(yào)求)。
項目結題的(de)關中心流程
![]() 附件(jiàn)2-臨床試驗結題核查表(專業(yè)組).docx
附件(jiàn)2-臨床試驗結題核查表(專業(yè)組).docx